Ramipril Kopen Online
- Farmacologische eigenschappen
- Indicaties
- Contra-indicaties
- Interacties met andere geneesmiddelen en andere vormen van interactie
- Dosering en administratie
- Overdosis
- Bijwerkingen
- Tenminste houdbaar tot
- Opslag condities
- Diagnose
- Aanbevolen analogen
- Ruilnamen
Verbinding
werkzame stof: ramipril;
1 tablet bevat ramipril 2,5 mg of 5 mg of 10 mg;
Hulpstoffen:
tabletten van 2,5 mg: hypromelose, microkristallijne cellulose (PH 112), microkristallijne cellulose (PH 101), voorverstijfseld zetmeel, rood ijzeroxide (E 172), natriumstearylfumaraat;
5 mg tabletten: hypromelose, microkristallijne cellulose (PH 112), microkristallijne cellulose (PH 101), voorverstijfseld zetmeel, geel ijzeroxide (E 172), natriumstearylfumaraat;
10 mg tabletten: hypromelose, microkristallijne cellulose persoonlijk (PH 112), microkristallijne cellulose (PH 101), voorverstijfseld zetmeel, geel ijzeroxide (E 172), natriumstearylfumaraat;
Doseringsvorm
Tabletten.
Fundamentele fysische en chemische eigenschappen:
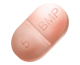
2,5 mg tabletten: roze tot rood gevlekte tabletten, langwerpig van vorm, gemarkeerd met R en 18 aan beide zijden van de verdeelstreep aan de ene kant van de tablet en met de verdeelstreep aan de andere kant;
5 mg tabletten: lichtgele tot geel gevlekte tabletten, langwerpig van vorm, met de aanduiding R en 19 aan beide zijden van de verdeelstreep aan de ene kant van de tablet en met de verdeelstreep aan de andere kant;
10 mg tabletten: lichtgele tot geel gevlekte tabletten, langwerpig van vorm, met de aanduiding R en 20 aan beide zijden van de verdeelstreep aan de ene kant van de tablet en met de verdeelstreep aan de andere kant.
Farmacotherapeutische groep
Angiotensine-converting enzyme (ACE)-remmers, monocomponent. Ramipril.
ATS-code C09A A05.
Farmacologische eigenschappen
Farmacodynamiek.
Werkingsmechanisme
Ramiprilaat, de actieve metaboliet van de prodrug ramipril, is een remmer van het enzym dipeptidylcarboxypeptidase I (synoniemen: angiotensine-converterend enzym; kinase II). In plasma en weefsels katalyseert dit enzym de omzetting van angiotensine I in angiotensine II (een actieve vasoconstrictor) en splitsing van de actieve vasodilatator bradykinine. Een afname van de vorming van angiotensine II en remming van de afbraak van bradykinine leiden tot vasodilatatie. Omdat angiotensine II ook de afgifte van aldosteron stimuleert, leidt ramiprilaat tot een afname van de aldosteronsecretie. De respons op monotherapie met ACE-remmers was gemiddeld genomen minder uitgesproken bij patiënten van zwarte (Afro-Caribische afkomst) met arteriële hypertensie (een populatie gekenmerkt door lage reninespiegels bij hypertensie) dan bij patiënten van andere rassen.
Antihypertensieve eigenschappen
Ontvangst van ramipril leidt tot een significante afname van de perifere arteriële weerstand. In de regel zijn er geen significante veranderingen in de renale plasmastroom of glomerulaire filtratiesnelheid. De benoeming van ramipril bij patiënten met arteriële hypertensie leidt tot een verlaging van de bloeddruk in zowel de horizontale als de verticale positie van de patiënt, wat niet gepaard gaat met een compenserende toename van de hartslag.
Bij de meeste patiënten treedt het antihypertensieve effect 1-2 uur na orale toediening van een enkele dosis van het geneesmiddel op. Het maximale effect na inname van een enkele dosis treedt meestal op na 3-6 uur. Het antihypertensieve effect na inname van een enkele dosis houdt gewoonlijk 24 uur aan.
Bij langdurige behandeling met ramipril is de maximale an bloeddrukverlagend effect ontwikkelt zich na 3-4 weken. Het is bewezen dat bij langdurige therapie het antihypertensieve effect 2 jaar aanhoudt.
Plotselinge stopzetting van ramipril leidt niet tot een snelle en overmatige stijging van de bloeddruk (rebound-fenomeen).
Hartfalen
Gebruikt als aanvulling op de traditionele therapie met diuretica en, indien nodig, hartglycosiden, is aangetoond dat ramipril effectief is bij patiënten met NYHA functioneel klasse II-IV hartfalen. Het medicijn heeft een gunstig effect op de cardiale hemodynamiek (vermindering van de vuldruk van de linker en rechter ventrikels, totale perifere vasculaire weerstand, verhoogde cardiale output en verbeterde cardiale index). Het vermindert ook neuro-endocriene activering.
Klinische werkzaamheid en veiligheid
Preventie van hart- en vaatziekten / nefroprotectie
Een preventieve placebogecontroleerde studie (de HOPE-studie) werd uitgevoerd bij meer dan 9.200 patiënten die naast de standaardtherapie ramipril kregen. Deze studie omvatte patiënten met een hoog risico op HVZ na eerdere atherotrombotische HVZ (voorgeschiedenis van coronaire hartziekte, beroerte of perifere vasculaire ziekte) of patiënten met diabetes mellitus die ten minste een extra risicofactor (gedocumenteerde microalbuminurie, hypertensie, verhoogd totaal cholesterol, lipoproteïne-cholesterol met lage dichtheid of roken).
Deze studie toonde aan dat ramipril de incidentie van myocardinfarct, cardiovasculaire dood en beroerte statistisch significant verminderde, zowel alleen als in combinatie (primair samengesteld eindpunt).
Tabel 1. HOPE-onderzoek: belangrijkste resultaten
| Inhoudsopgave | Ramipril | placebo | Relatief risico (95% betrouwbaarheidsinterval) | p-waarde |
| % | % | |||
| Alle patiënten | n=4.645 | N=4.652 | ||
| Primair gecombineerd eindpunt | veertien | 17.8 | < td style="breedte: 143px; hoogte: 36px;">0,78 (0,7−0,86)<0.001 | |
| myocardinfarct | 9.9 | 12.3 | 0,80 (0,7-0,9) | <0.001 |
| Cardiovasculaire dood | 6.1 | 8.1 | 0,74 (0,64-0,87) | <0.001 |
| Hartinfarct | 3.4 | 4.9 | 0,68 (0,56-0,84) | <0.001 |
| Secundaire eindpunten | ||||
| Dood om welke reden dan ook | 10.4 | 0,84 (0,75-0,95) | 0,005 | |
| Behoefte aan revascularisatie | 16.0 | 18.3 | 0,85 (0,77-0,94) | 0,002 |
| Ziekenhuisopname voor onstabiele angina | 12.1 | 12.3 | 0,98 (0,87-1,1) | niet betrouwbaar |
| Ziekenhuisopname voor hartfalen | 3.2 | 3.5 | 0,88 (0,7-1,1) | 0,25 |
| Complicaties geassocieerd met diabetes | 6.4 | 7.6 | 0,84 (0,72-0,98) | 0.03 |
De MICRO-HOPE-studie, gepland als onderdeel van de HOPE-studie, onderzocht het effect van toevoeging van ramipril 10 mg aan een bestaande behandeling versus placebo bij 3.577 patiënten ouder dan 55 jaar (geen bovengrens) met normale of verhoogde bloeddruk, van wie de meesten diabetes type 2 hadden (en minstens één cardiovasculaire risicofactor hadden).
De resultaten van de primaire analyse toonden aan dat 117 (6,5%) deelnemers aan de studie die ramipril kregen en 149 (8,4%) die placebo kregen, ernstige nefropathie ontwikkelden, wat overeenkomt met een relatieve risicoreductie van 24%; 95% BI [3-40], p = 0,027.
De REIN-studie, een multicenter, gerandomiseerde, dubbelblinde, placebogecontroleerde studie met parallelle groepen, werd uitgevoerd om het effect van de behandeling met ramipril op de mate van afname van de glomerulaire filtratiesnelheid (GFR) te evalueren bij 352 patiënten met normale of verhoogde bloeddruk (in de leeftijd van 18-70 jaar) die milde (gemiddeld uitgescheiden eiwit in de urine > 1 en < 3 g/dag) of ernstige proteïnurie (≥ 3 g/dag) hadden als gevolg van chronische niet-diabetische nefropathie. Beide subgroepen waren prospectief gestratificeerd.
De resultaten van de hoofdanalyse van de status van patiënten met de meest ernstige proteïnurie (subgroep, vroegtijdige stopzetting van deelname aan studie, omdat er bewijs was van behandelingsvoordeel in de ramiprilgroep) toonde aan dat de gemiddelde intensiteit van GFR-reductie per maand lager was met ramipril dan met placebo: -0,54 (0,66) vergeleken met -0,88 (1,03) ml/min/ maand, p = 0,038. Het verschil tussen de groepen was dus 0,34 [0,03–0,65] ml/min/maand en ongeveer 4 ml/min/jaar; 23,1% van de patiënten in de ramiprilgroep bereikte het gecombineerde secundaire eindpunt van een verdubbeling van het plasmacreatinine en/of terminale nierziekte (hemodialyse of niertransplantatie nodig) vergeleken met 45,5% in de placebogroep (p = 0, 02).
Dubbele blokkade van het renine-angiotensine-aldosteronsysteem (RAAS). Twee grote gerandomiseerde gecontroleerde onderzoeken [ONTARGET (een onderzoek naar het effect van telmisartan alleen en in combinatie met ramipril op een gemeenschappelijk eindpunt) en VA NEPHRON-D (een onderzoek naar diabetische nefropathie bij veteranen)] bestudeerden de combinatie van een ACE-remmer met een tegenstander.
Het ONTARGET-onderzoek werd uitgevoerd bij patiënten met een voorgeschiedenis van cardiovasculaire of cerebrovasculaire aandoeningen of diabetes mellitus type 2 met bijkomende tekenen van schade aan doelorganen. De VA NEPHRON-D-studie omvatte patiënten met diabetes type 2 en diabetische nefropathie.
Deze studies toonden geen significante voordelen van combinatietherapie in relatie tot en renale en/of cardiovasculaire gevolgen en mortaliteit, terwijl er een verhoogd risico was op hyperkaliëmie, acuut nierfalen en/of arteriële hypotensie in vergelijking met monotherapie. Gezien de vergelijkbare farmacodynamische kenmerken van deze geneesmiddelen, zijn deze resultaten ook van toepassing op andere ACE-remmers en angiotensine II-receptorantagonisten.
Daarom mogen ACE-remmers en angiotensine-II-receptorantagonisten niet gelijktijdig worden gebruikt bij patiënten met diabetische nefropathie.
De ALTITUDE-studie (Aliskiren Study on Type 2 Diabetes Using Cardiovascular and Renal Endpoints) evalueerde de voordelen van toevoeging van aliskiren aan standaardtherapie met een ACE-remmer of angiotensine II-receptorantagonist bij patiënten met chronische nierziekte, cardiovasculaire ziekte of beide. Deze studie werd voortijdig beëindigd vanwege een verhoogd risico op ongunstige klinische uitkomsten. In de aliskirengroep was er, vergeleken met de placebogroep, een hogere incidentie van overlijden door cardiovasculaire oorzaken en beroerte, evenals een toename van de frequentie van ernstige bijwerkingen die van bijzonder belang zijn (hyperkaliëmie, arteriële hypotensie en nierdisfunctie).
Secundaire preventie na acuut myocardinfarct. Meer dan 2.000 patiënten met voorbijgaande/permanente Symptomen van hartfalen na een hartinfarct. De behandeling met ramipril werd gestart 3-10 dagen na het begin van een acuut myocardinfarct. Deze studie toonde aan dat na een mediane follow-upperiode van 15 maanden de mortaliteit 16,9% bedroeg in de ramiprilgroep en 22,6% in de placebogroep. Dit betekent een absolute reductie in mortaliteit van 5,7% en een relatieve risicoreductie van 27% (95% BI [11-40%]).
pediatrische populatie. In een gerandomiseerde, dubbelblinde, placebogecontroleerde klinische studie bij 244 pediatrische patiënten met hypertensie (van wie 73% primaire hypertensie had), in de leeftijd van 6 tot 16 jaar, kregen de deelnemers lage, gemiddelde of hoge doses ramipril om plasmaspiegels te bereiken. ramiprilaatconcentraties die overeenkomen met het doseringsbereik voor volwassenen van 1,25 mg; 5 en 20 mg op basis van lichaamsgewicht. Aan het einde van de periode van 4 weken bleek ramipril niet effectief te zijn met betrekking tot het eindpunt van verlaging van de systolische bloeddruk, maar het verlaagde wel de diastolische druk bij de hoogste Altace België dosis van het studiebereik. Van zowel middelhoge als hoge doses ramipril is aangetoond dat ze de systolische en diastolische bloeddruk met een statistisch significante hoeveelheid verlagen bij kinderen met gedocumenteerde hypertensie.
Ik zie dit effect niet. werd gegeven in een 4 weken durend, gerandomiseerd, dubbelblind, dosis-escalatieonderzoek waarin het effect van het staken van het geneesmiddel werd geëvalueerd bij 218 pediatrische patiënten van 6-16 jaar (van wie 75% primaire hypertensie had). In deze studie werd een matige stijging van zowel de diastolische als de systolische druk waargenomen na stopzetting van het geneesmiddel, maar deze was niet statistisch significant voor de terugkeer van de druk naar de uitgangswaarde in alle dosisgroepen van het onderzoeksbereik van ramipril [lage doses (0,625 mg - 2,5 mg, gemiddelde doses (2,5 mg - 10 mg) of hoge doses (5 mg - 20 mg)] op basis van lichaamsgewicht. In de pediatrische onderzoekspopulatie had ramipril geen lineair dosisafhankelijk effect.
Farmacokinetiek.
Zuig
Na orale toediening wordt ramipril snel geabsorbeerd uit het maagdarmkanaal. De maximale plasmaconcentratie wordt binnen 1 uur bereikt. Gezien de hoeveelheid van de stof die in de urine wordt aangetroffen, is de mate van absorptie ten minste 56% en heeft deze geen significante invloed op de beschikbaarheid van voedsel in het maagdarmkanaal. De biologische beschikbaarheid van de actieve metaboliet van ramiprilaat na orale toediening van een dosis van 2,5 mg en 5 mg is 45%.
De maximale plasmaconcentratie van ramiprilaat, de enige actieve metaboliet van ramipril, wordt 2-4 uur na inname van ramipril bereikt. Na conventionele doses ramipr slib 1 keer per dag, wordt de evenwichtsconcentratie van ramiprilaat in het plasma ongeveer op de 4e dag van de behandeling bereikt.
Verdeling
De binding van ramipril aan plasma-eiwitten is ongeveer 73% en die van ramiprilaat is 56%.
Metabolisme
Ramipril wordt bijna volledig gemetaboliseerd tot ramiprilaat, diketopiperazine-ester, diketopiperazinezuur en ramipril en ramiprilaatglucuroniden.
fokken
Uitscheiding van metabolieten vindt voornamelijk plaats door uitscheiding via de nieren. De daling van de plasmaconcentraties van ramiprilaat verloopt in meerdere fasen. Vanwege de sterke verzadigende binding aan ACE en de langzame dissociatie van de associatie met het enzym, heeft ramiprilaat een verlengde terminale eliminatiefase bij zeer lage plasmaconcentraties.
Na inname van herhaalde doses ramipril 1 keer per dag is de effectieve halfwaardetijd 13-17 uur voor doses van 5-10 mg en meer voor lage doses (1,25-2,5 mg). Het verschil is te wijten aan het feit dat het vermogen van het enzym om aan ramiprilaat te binden verzadigd is.
Bij orale inname in een enkele dosis werden noch ramipril, noch zijn metaboliet in de moedermelk aangetroffen. Het is echter niet bekend welk effect herhaalde doses hebben.
Patiënten met een verminderde nierfunctie (zie rubriek "Wijze van toediening en dosering")
Bij patiënten met een verminderde nierfunctie is de renale excretie van ramiprilaat verminderd en de renale klaring van ramiprilaat is evenredig met de creatinineklaring. . Dit leidt tot een verhoging van de plasmaconcentratie van ramiprilaat, die langzamer daalt dan bij personen met een normale nierfunctie.
Patiënten met een verminderde leverfunctie (zie rubriek "Wijze van aanbrengen en dosering")
Bij patiënten met een verminderde leverfunctie was het metabolisme van ramipril tot ramiprilaat vertraagd als gevolg van een afname van de activiteit van hepatische esterasen, en de plasmaspiegels van ramipril bij deze patiënten waren verhoogd. De maximale concentraties van ramiprilaat bij deze patiënten verschilden echter niet van die bij personen met een normale leverfunctie.
Borstvoeding
Na een enkelvoudige orale dosis ramipril waren de spiegels in de moedermelk beneden de detectiegrens. Het effect van herhaald gebruik is echter niet bekend.
Pediatrische populatie
Het farmacokinetisch goedkope Altace profiel van ramipril werd bestudeerd bij 30 pediatrische patiënten met arteriële hypertensie in de leeftijd van 2 tot 16 jaar die meer dan 10 kg wogen. Na doses van 0,05-0,2 mg/kg werd ramipril snel en uitgebreid gemetaboliseerd tot ramiprilaat. De maximale plasmaconcentratie van ramiprilaat werd na 2-3 uur bereikt. De klaring van ramiprilaat was significant gecorreleerd met de logaritme van het lichaamsgewicht (p < 0,01), evenals met de dosis van het geneesmiddel (p < 0,001). De klaring en het distributievolume namen in elke doseringsgroep recht evenredig met de leeftijd toe. Bij een dosis van 0,05 mg/kg werden bij kinderen EC-spiegels bereikt. blootstelling vergelijkbaar met blootstelling bij volwassenen bij gebruik en doses van 5 mg ramipril. Door het gebruik van een dosis van 0,2 mg/kg bij kinderen werden blootstellingsniveaus bereikt die hoger waren dan bij gebruik van de maximaal aanbevolen dosis van 10 mg/dag bij volwassenen.
Preklinische veiligheidsgegevens
Bij orale toediening aan knaagdieren en honden bleek ramipril geen acute toxische effecten te veroorzaken. Een studie met langdurige orale toediening van het geneesmiddel werd uitgevoerd bij ratten, honden en apen. Bij al deze drie diersoorten werden veranderingen in de elektrolytenbalans en bloedpatronen waargenomen. Bij honden en apen die werden behandeld met het geneesmiddel in een dosis van 250 mg / kg lichaamsgewicht per dag, werd een significante toename van het juxtaglomerulaire apparaat waargenomen, wat een manifestatie is van de farmacodynamische activiteit van ramipril. Ratten, honden en apen verdroegen dagelijkse doses van 2; respectievelijk 2,5 en 8 mg/kg lichaamsgewicht per dag. Tegelijkertijd hadden ze geen ongewenste effecten.
Reproductieve toxiciteitsstudies uitgevoerd bij ratten, konijnen en apen hebben geen teratogene eigenschappen van het geneesmiddel aan het licht gebracht. Negatieve effecten op de vruchtbaarheid werden niet waargenomen bij mannelijke of vrouwelijke ratten.
Toediening van ramipril aan vrouwtjesratten tijdens dracht en lactatie resulteerde in onomkeerbare nierbeschadiging (dilatatie van het nierbekken) bij nakomelingen bij doses van 50 mg/kg lichaamsgewicht per dag en hoger.
Talrijke mutageniteitstests met behulp van verschillende x-testsystemen brachten geen mutagene of genotoxische eigenschappen van ramipril aan het licht.
Klinische kenmerken
Indicaties
Behandeling van arteriële hypertensie.
Preventie van hart- en vaatziekten: vermindering van cardiovasculaire morbiditeit en mortaliteit bij patiënten met:
- ernstige cardiovasculaire ziekte van atherotrombotische oorsprong (voorgeschiedenis van coronaire hartziekte of beroerte of perifere vasculaire ziekte);
- diabetes als de patiënt ten minste één cardiovasculaire risicofactor heeft (zie rubriek "Farmacologische eigenschappen").
Behandeling van nierziekte:
- initiële glomerulaire diabetische nefropathie, zoals blijkt uit de aanwezigheid van microalbuminurie;
- ernstige glomerulaire diabetische nefropathie, zoals blijkt uit de aanwezigheid van macroproteïnurie, bij patiënten met ten minste één cardiovasculaire risicofactor (zie rubriek "Farmacologische eigenschappen");
- ernstige glomerulaire niet-diabetische nefropathie, zoals blijkt uit de aanwezigheid van macroproteïnurie ≥ 3 g/dag (zie rubriek "Farmacologische eigenschappen").
Behandeling van hartfalen, vergezeld van klinische manifestaties.
Secundaire preventie na een acuut myocardinfarct: vermindering van de mortaliteit tijdens de acute fase van een myocardinfarct bij patiënten met klinische tekenen van hartfalen leverfalen bij het starten van de behandeling meer dan 48 uur na het begin van een acuut myocardinfarct.
Contra-indicaties
Overgevoeligheid voor de werkzame stof of voor één van de hulpstoffen waaruit het geneesmiddel bestaat, of voor andere ACE-remmers (angiotensine-converterend enzym) (zie rubriek "Samenstelling").
Een voorgeschiedenis van angio-oedeem (erfelijk, idiopathisch of eerder overgedragen op de achtergrond van het gebruik van ACE-remmers of angiotensine II-receptorantagonisten).
Gelijktijdig gebruik met sacubitril / valsartan (zie rubrieken "Bijzonderheden van gebruik" en "Interactie met andere geneesmiddelen en andere soorten interacties").
Significante bilaterale nierarteriestenose of nierarteriestenose in de aanwezigheid van een enkele functionerende nier.
Zwangerschap en zwangerschapsplanning (zie rubriek "Gebruik tijdens zwangerschap en borstvoeding").
Ramipril mag niet worden gebruikt bij patiënten met arteriële hypotensie of hemodynamisch onstabiele aandoeningen.
Gelijktijdig gebruik van Laceran met geneesmiddelen die aliskiren bevatten, is gecontra-indiceerd bij patiënten met diabetes mellitus of nierdisfunctie (glomerulaire filtratiesnelheid (GFR) < 60 ml / min / 1,73 m2) (zie rubrieken "Interactie met andere geneesmiddelen en andere soorten interacties" en farmacodynamiek).
Het is noodzakelijk om gelijktijdig gebruik van ACE-remmers en extracorporale therapieën te vermijden die leiden tot bloedcontact met negatief geladen oppervlakken (zie de rubriek "Interactie met andere geneesmiddelen en andere soorten interacties").
Interacties met andere geneesmiddelen en andere vormen van interactie
Gegevens uit klinische onderzoeken hebben aangetoond dat dubbele blokkade van het renine-angiotensine-aldosteronsysteem (RAAS) door het gecombineerde gebruik van ACE-remmers, angiotensine-II-receptorantagonisten of aliskiren gepaard gaat met een verhoogde incidentie van bijwerkingen zoals arteriële hypotensie en verslechtering van de nierfunctie (inclusief acuut nierfalen), in vergelijking met het gebruik van slechts één middel dat de RAAS beïnvloedt (zie rubrieken "Contra-indicaties", "Bijzonderheden bij het gebruik" en "Farmacodynamiek").
Gecontra-indiceerde combinaties
Gelijktijdig gebruik van ACE-remmers met sacubitril / valsartan is gecontra-indiceerd vanwege een verhoogd risico op het ontwikkelen van angio-oedeem (zie rubrieken "Contra-indicaties" en "Bijzonderheden bij het gebruik"). De behandeling met ramipril moet 36 uur na de laatste dosis sacubitril/valsartan beginnen. De behandeling met sacubitril/valsartan dient 36 uur na de laatste dosis ramipril te beginnen.
Extracorporale methoden therapieën die bloed in contact brengen met negatief geladen oppervlakken, zoals dialyse of hemofiltratie met behulp van bepaalde high-flow membranen (zoals polyacrylonitrilmembranen) en low-density lipoproteïne-aferese met dextraansulfaat, gezien het verhoogde risico op ernstige anafylactoïde reacties (zie "Contra-indicaties") "). Als een dergelijke behandeling noodzakelijk is, moet worden overwogen om een ander dialysemembraan of een andere klasse antihypertensiva te gebruiken.
Combinaties die voorzorgsmaatregelen vereisen
Kaliumzouten, heparine, kaliumsparende diuretica en andere werkzame stoffen die de kaliumspiegel in het bloedplasma verhogen (waaronder angiotensine II-antagonisten, trimethoprim en de vaste combinaties daarvan met sulfamethoxazol, tacrolimus, ciclosporine). Er kan hyperkaliëmie optreden, dus plasmakaliumspiegels moeten zorgvuldig worden gecontroleerd.
Antihypertensiva (bijv. diuretica) en andere stoffen die de bloeddruk kunnen verlagen (bijv. nitraten, tricyclische antidepressiva, anesthetica, alcohol, baclofen, alfuzosine, doxazosine, prazosine, tamsulosine, terazosine). Er moet een verhoogd risico op arteriële hypotensie worden verwacht (zie rubriek "Bijzonderheden bij het gebruik" met betrekking tot diuretica).
Vasopressorsympathicomimetica en andere stoffen (bijv. isoproterenol, dobutamine, dopa min, epinefrine), die het antihypertensieve effect van Laceran kunnen verminderen. Het wordt aanbevolen om de bloeddruk zorgvuldig te controleren.
Alopurinol, immunosuppressiva, corticosteroïden, procaïnamide, cytostatica en andere stoffen die kunnen leiden tot veranderingen in het bloedbeeld. Verhoogde kans op hematologische reacties (zie rubriek "Bijzonderheden van gebruik").
Lithium zouten. ACE-remmers kunnen de lithiumuitscheiding verminderen, wat kan leiden tot verhoogde lithiumtoxiciteit. Lithiumniveaus moeten zorgvuldig worden gecontroleerd.
Antidiabetica, waaronder insuline. Hypoglykemische reacties kunnen optreden. Het wordt aanbevolen om de bloedglucosewaarden zorgvuldig te controleren.
Niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's) en acetylsalicylzuur. Een afname van het antihypertensieve effect van het geneesmiddel Laceran wordt verwacht. Bovendien kan het gelijktijdig gebruik van ACE-remmers en NSAID's gepaard gaan met een verhoogd risico op verslechtering van de nierfunctie en een verhoging van het kaliumgehalte in het bloed.
Zout. Bij overmatige zoutinname kan het hypotensieve effect van het medicijn worden verzwakt.
Specifieke hyposensibilisatie. Als gevolg van ACE-remming neemt de waarschijnlijkheid en ernst van anafylactische en anafylactoïde reacties op insectengif toe. Er wordt aangenomen dat dit effect ook kan worden waargenomen in relatie tot andere allergenen.
Zoogdierdoelwitremmers van rapamycine (mTOR) of vildagliptine. Het is mogelijk om ri te verhogen ska ontwikkeling van angio-oedeem bij patiënten die gelijktijdig geneesmiddelen krijgen zoals mTOR-remmers (bijv. temsirolimus, everolimus, sirolimus) of vildagliptine. Ga voorzichtig te werk bij een dergelijke therapie (zie rubriek "Bijzonderheden van het gebruik").
Racecadotril. Een mogelijke verhoging van het risico op het ontwikkelen van angio-oedeem is gemeld bij gelijktijdig gebruik van ACE-remmers en een remmer van NEP (neutrale endopeptidase), zoals racecadotril (zie rubriek "Bijzonderheden bij het gebruik").
sacubitril/valsartan. Gelijktijdig gebruik van ACE-remmers met sacubitril/valsartan is gecontra-indiceerd vanwege een verhoogd risico op angio-oedeem.
Toepassingsfuncties
Speciale patiëntengroepen
Zwangerschap. Behandeling met ACE-remmers of angiotensine-II-receptorantagonisten mag niet worden gestart tijdens de zwangerschap. Tenzij voortzetting van de behandeling met een ACE-remmer/angiotensine-II-receptorantagonist absoluut noodzakelijk is, moeten patiënten die van plan zijn zwanger te worden, worden overgezet op een ander antihypertensivum dat als veilig wordt beschouwd voor gebruik tijdens de zwangerschap. Zodra zwangerschap wordt vastgesteld, moet de behandeling met ACE-remmers / angiotensine-II-receptorantagonisten onmiddellijk worden stopgezet en, indien nodig, moet een behandeling met een ander geneesmiddel worden gestart (zie rubrieken "Contra-indicaties" en "Gebruik tijdens zwangerschap). of borstvoeding).
Dubbele blokkade van het renine-angiotensine-aldosteronsysteem (RAAS). Er zijn aanwijzingen dat het gelijktijdig gebruik van ACE-remmers, angiotensine-II-receptorantagonisten of aliskiren het risico op arteriële hypotensie, hyperkaliëmie en verslechtering van de nierfunctie (inclusief de ontwikkeling van acuut nierfalen) verhoogt. In dit verband wordt de dubbele blokkade van het RAAS door het gecombineerde gebruik van ACE-remmers, angiotensine-II-receptorantagonisten of aliskiren niet aanbevolen (zie rubrieken "Interactie met andere geneesmiddelen en andere vormen van interactie" en "Farmacodynamiek").
Als therapie in de vorm van een dergelijke dubbele blokkade als absoluut noodzakelijk wordt beschouwd, mag deze alleen worden gebruikt onder toezicht van een specialist en met frequente en zorgvuldige controle van de nierfunctie, elektrolyten en bloeddrukniveaus.
ACE-remmers en angiotensine-II-receptorantagonisten mogen niet gelijktijdig worden gebruikt bij patiënten met diabetische nefropathie.
Patiënten met een bijzonder risico op arteriële hypotensie
Patiënten met een significante toename van de activiteit van het renine-angiotensine-aldosteronsysteem. Patiënten met een significante toename van de activiteit van het renine-angiotensine-aldosteronsysteem lopen het risico op een plotselinge significante verlaging van de bloeddruk en verslechtering van de nierfunctie als gevolg van ACE-remming, vooral als een ACE-remmer of gelijktijdige medicatie de ureticum wordt voor de eerste keer voorgeschreven of de dosis wordt voor de eerste keer verhoogd. Een significante toename van de activiteit van het renine-angiotensine-aldosteronsysteem, waarvoor medisch toezicht nodig is, inclusief constante bewaking van de bloeddruk, kan bijvoorbeeld worden verwacht bij patiënten:
- met ernstige arteriële hypertensie;
- met gedecompenseerd congestief hartfalen;
- met een hemodynamisch significante obstructie van de instroom of uitstroom van bloed uit de linker ventrikel (bijvoorbeeld met stenose van de aorta- of mitralisklep);
- met unilaterale stenose van de nierslagader in aanwezigheid van een tweede functionerende nier;
- die een tekort aan vocht of elektrolyten hebben of kunnen krijgen (inclusief degenen die diuretica krijgen);
- met cirrose van de lever en / of ascites;
- die een grote operatie uitvoeren of tijdens anesthesie met het gebruik van geneesmiddelen die arteriële hypotensie veroorzaken.
In de regel wordt aanbevolen om dehydratie, hypovolemie of gebrek aan elektrolyten te corrigeren voordat met de behandeling wordt begonnen (bij patiënten met hartfalen moeten dergelijke corrigerende maatregelen echter zorgvuldig worden afgewogen tegen het risico van volume-overbelasting).
Voorbijgaand of aanhoudend hartfalen na een hartinfarct.
Patiënten met een risico op cardiale of cerebrale ischemie in geval van acute arteriële hypotensie. In de beginfase van de behandeling is speciaal medisch toezicht vereist.
Een patiënt s van gevorderde leeftijd. Zie de rubriek "Wijze van toediening en dosering".
Chirurgische ingreep. Indien mogelijk dient de behandeling met remmers van het angiotensine-converterende enzym, zoals ramipril, 1 dag voor de operatie te worden gestaakt.
Controle van de nierfunctie. De nierfunctie moet voor en tijdens de behandeling worden beoordeeld en de dosis moet worden aangepast, vooral in de eerste weken van de behandeling. Bijzonder zorgvuldige controle is noodzakelijk voor de toestand van patiënten met een verminderde nierfunctie (zie rubriek "Wijze van toediening en dosering"). Er is een risico op verslechtering van de nierfunctie, vooral bij patiënten met congestief hartfalen of na een niertransplantatie, evenals bij niervasculaire aandoeningen, inclusief bij patiënten met hemodynamisch significante unilaterale nierarteriestenose.
Angio-oedeem. Bij patiënten die werden behandeld met ACE-remmers, waaronder ramipril, werd angio-oedeem waargenomen (zie rubriek "Bijwerkingen"). Dit risico is groter bij patiënten die gelijktijdig geneesmiddelen krijgen, zoals zoogdierdoelwit-rapamycineremmers (mTOR-remmers) (bijv. temsirolimus, everolimus, sirolimus) of vildagliptine of racecadotril.
De combinatie van ramipril met sacubitril/valsartan is gecontra-indiceerd vanwege een verhoogd risico op angio-oedeem (zie rubrieken "Contra-indicaties" en "Interacties met andere geneesmiddelen en andere vormen van interactie". ja ;).
In geval van angio-oedeem dient het gebruik van Laceran te worden gestaakt. U moet onmiddellijk met een spoedbehandeling beginnen. De patiënt moet gedurende ten minste 12-24 uur onder controle zijn en kan worden ontslagen nadat de symptomen volledig zijn verdwenen.
Bij patiënten die werden behandeld met ACE-remmers, waaronder Laceran, werden gevallen van angio-oedeem van de darm waargenomen (zie rubriek "Bijwerkingen"). Deze patiënten klaagden over buikpijn (met of zonder misselijkheid of braken).
Anafylactische reacties tijdens desensibilisatie. Met het gebruik van ACE-remmers neemt de waarschijnlijkheid en ernst van anafylactische en anafylactoïde reacties op insectengif en andere allergenen toe. Vóór desensibilisatie moet u tijdelijk stoppen met het gebruik van het medicijn Laceran.
Controle van de elektrolytenbalans. Hyperkaliëmie. Hyperkaliëmie is waargenomen bij sommige patiënten die werden behandeld met ACE-remmers, waaronder Laceran. De risicogroep voor hyperkaliëmie omvat patiënten met nierinsufficiëntie, patiënten ouder dan 70 jaar, patiënten met ongecontroleerde diabetes mellitus, patiënten die kaliumzouten, kaliumsparende diuretica gebruiken, evenals andere werkzame stoffen die het kaliumgehalte in het bloedplasma verhogen of patiënten met aandoeningen zoals uitdroging, acute hartdecompensatie, metabole acidose. Als het gecombineerde gebruik van de bovengenoemde medicijnen geschikt wordt geacht, dan de rivieren Het wordt aanbevolen om regelmatig de kaliumspiegel in het bloedplasma te controleren (zie rubriek "Interacties met andere geneesmiddelen en andere soorten interacties").
Controle van de elektrolytenbalans. Hyponatriëmie. Bij sommige patiënten die met ramipril werden behandeld, was er een syndroom van ongepaste secretie van antidiuretisch hormoon met de ontwikkeling van hyponatriëmie. Het wordt aanbevolen om de serumnatriumspiegels regelmatig te controleren bij ouderen en andere patiënten die het risico lopen hyponatriëmie te ontwikkelen.
Neutropenie/Agranulocytose. Gevallen van neutropenie/agranulocytose, evenals trombocytopenie en anemie, waren zeldzaam. Beenmergsuppressie is ook gemeld. Om mogelijke leukopenie op te sporen, wordt aanbevolen om het aantal leukocyten in het bloed te controleren. Frequentere controle is wenselijk aan het begin van de behandeling en bij patiënten met een verminderde nierfunctie, gelijktijdige collagenose (bijvoorbeeld systemische lupus erythematosus of sclerodermie), of patiënten die andere geneesmiddelen gebruiken die veranderingen in het bloedbeeld kunnen veroorzaken (zie rubrieken "Interactie met andere geneesmiddelen en andere soorten interacties” en “Bijwerkingen”).
etnische verschillen. ACE-remmers veroorzaken vaker angio-oedeem bij patiënten van het zwarte ras dan bij andere rassen. Net als bij andere ACE-remmers kan het hypotensieve effect van ramipril minder Altace prijs uitgesproken zijn bij patiënten van het zwarte ras dan bij vertegenwoordigers van een ander ras. hun rassen. Dit kan te wijten zijn aan het feit dat negroïde patiënten met arteriële hypertensie meer kans hebben op arteriële hypertensie met lage renine-activiteit.
Hoesten. Hoesten is gemeld bij het gebruik van ACE-remmers. Het is kenmerkend dat de hoest onproductief is, langdurig is en verdwijnt na stopzetting van de therapie. Bij de differentiaaldiagnose van hoesten dient men zich bewust te zijn van de mogelijkheid van hoesten door het gebruik van ACE-remmers.
Gebruik tijdens zwangerschap of lactatie
Zwangerschap
Het medicijn is gecontra-indiceerd voor zwangere vrouwen of vrouwen die van plan zijn zwanger te worden. Als zwangerschap wordt vastgesteld tijdens de behandeling, moet het geneesmiddel onmiddellijk worden stopgezet en, indien nodig, worden vervangen door een ander goedgekeurd geneesmiddel (zie rubriek "Contra-indicaties").
Borstvoeding
Vanwege het gebrek aan informatie over het gebruik van ramipril tijdens het geven van borstvoeding (zie rubriek "Farmacologische eigenschappen"), wordt het niet aanbevolen dit geneesmiddel voor te schrijven aan vrouwen die borstvoeding geven, en is het wenselijk om de voorkeur te geven aan andere geneesmiddelen, het gebruik van wat tijdens borstvoeding veiliger is, vooral op de borst. het voeden van pasgeborenen of te vroeg geboren baby's.
Het vermogen om de reactiesnelheid te beïnvloeden bij het besturen van voertuigen of het bedienen van andere mechanismen
Sommige bijwerkingen (zoals symptomen we verlagen de bloeddruk, zoals duizeligheid) kunnen het concentratievermogen van de patiënt aantasten en de reactiesnelheid verminderen, wat riskant is in situaties waarin deze eigenschappen bijzonder belangrijk zijn (bijvoorbeeld bij het besturen van voertuigen of het werken met andere mechanismen).
Dit is meestal mogelijk aan het begin van de behandeling of bij het overschakelen van een behandeling met andere geneesmiddelen naar een behandeling met Laceran. Na inname van de eerste dosis of daaropvolgende dosisverhoging, is het niet raadzaam om gedurende enkele uren een voertuig te besturen of met andere mechanismen te werken.
Dosering en administratie
Voorbereiding voor orale toediening.
Het medicijn Laceran wordt aanbevolen om dagelijks op hetzelfde tijdstip te worden ingenomen. Het medicijn kan voor, tijdens en na de maaltijd worden ingenomen, aangezien voedselinname geen invloed heeft op de biologische beschikbaarheid van het medicijn. Laceran-tabletten moeten in hun geheel met water worden doorgeslikt. Ze mogen niet worden gekauwd of geplet.
Als het onmogelijk is om de voorgeschreven dosis te gebruiken, gebruik dan ramipril in de juiste dosering.
volwassenen
Patiënten die diuretica gebruiken. Aan het begin van de behandeling met Laceran kan arteriële hypotensie optreden, waarvan de ontwikkeling waarschijnlijker is bij patiënten die gelijktijdig diuretica krijgen. In dergelijke gevallen wordt aanbevolen om voorzichtig te zijn, aangezien deze patiënten een daling van de BCC en/of de hoeveelheid elektrolyten kunnen hebben.
Indien mogelijk is het raadzaam om te stoppen om een diureticum te gebruiken 2-3 dagen voor het begin van de behandeling met Laceran (zie rubriek "Bijzonderheden bij het gebruik").
Bij patiënten met arteriële hypertensie die het diureticum niet kunnen stoppen, dient de behandeling met Laceran te beginnen met een dosis van 1,25 mg (gebruik ramipril in de juiste dosering). De nierfunctie en de kaliumspiegel in het bloed moeten nauwlettend worden gecontroleerd. Verdere dosering van het medicijn Laceran moet worden aangepast afhankelijk van het beoogde bloeddrukniveau.
Arteriële hypertensie
De dosis moet individueel worden gekozen, afhankelijk van de kenmerken van de toestand van de patiënt (zie rubriek "Bijzonderheden bij het gebruik") en de resultaten van controlemetingen van de bloeddruk. Laceran kan worden gebruikt als monotherapie of in combinatie met andere klassen van antihypertensiva (zie rubrieken "Contra-indicaties", "Bijzonderheden van gebruik", "Interactie met andere geneesmiddelen en andere soorten interacties" en "Farmacodynamiek").
Initiële dosering. De behandeling met Laceran moet geleidelijk worden gestart, te beginnen met de aanbevolen aanvangsdosis van 2,5 mg (met ramipril in de juiste dosering) per dag.
Bij patiënten met significante activatie van het renine-angiotensine-aldosteronsysteem na inname van de startdosis kan een significante verlaging van de bloeddruk optreden. Voor dergelijke patiënten is de aanbevolen startdosis 1,25 mg (gebruik ram ipril in de juiste dosering), en hun behandeling moet onder controle worden gestart (zie rubriek "Bijzonderheden van het gebruik").
Dosistitratie en onderhoudsdosis. De dosis kan elke 2 tot 4 weken worden verdubbeld totdat de beoogde bloeddruk is bereikt; De maximale dosis Laceran is 10 mg/dag. In de regel wordt het medicijn 1 keer per dag ingenomen.
Preventie van hart- en vaatziekten
Initiële dosering. De aanbevolen aanvangsdosering van Laceran is 2,5 mg (gebruik ramipril in de juiste dosering) eenmaal daags.
Dosistitratie en onderhoudsdosis. Afhankelijk van de individuele verdraagbaarheid van het geneesmiddel, moet de dosis geleidelijk worden verhoogd. Het wordt aanbevolen om de dosis na 1 à 2 weken behandeling te verdubbelen en vervolgens na 2 à 3 weken te verhogen tot de beoogde onderhoudsdosis van 10 mg eenmaal daags.
Behandeling van nierziekte
Patiënten met diabetes en microalbuminurie
Initiële dosering. De aanbevolen aanvangsdosering van Laceran is 1,25 mg (gebruik ramipril in de juiste dosering) eenmaal daags.
Dosistitratie en onderhoudsdosis. Afhankelijk van de individuele verdraagbaarheid van het geneesmiddel tijdens verdere behandeling, wordt de dosis verhoogd. Na 2 weken behandeling wordt aanbevolen een enkele dagelijkse dosis te verdubbelen tot 2,5 mg (met ramipril in de juiste dosering) en vervolgens tot 5 mg na 2 weken behandeling.
Patiënten met diabetes en ten minste één cardiovasculaire risicofactor over risico
Initiële dosering. De aanbevolen aanvangsdosering van Laceran is 2,5 mg (gebruik ramipril in de juiste dosering) eenmaal daags.
Dosistitratie en onderhoudsdosis. Afhankelijk van de individuele verdraagbaarheid van het geneesmiddel tijdens verdere behandeling, wordt de dosis verhoogd. Na 1-2 weken behandeling wordt aanbevolen de dagelijkse dosis Laceran te verdubbelen tot 5 mg en vervolgens tot 10 mg na 2-3 weken behandeling. De beoogde dagelijkse dosering is 10 mg.
Patiënten met niet-diabetische nefropathie, zoals blijkt uit de aanwezigheid van macroproteïnurie ≥ 3 g per dag
Initiële dosering. De aanbevolen aanvangsdosering van Laceran is 1,25 mg (gebruik ramipril in de juiste dosering) eenmaal daags.
Dosistitratie en onderhoudsdosis. Afhankelijk van de individuele tolerantie van de patiënt voor het geneesmiddel tijdens verdere behandeling, wordt de dosis verhoogd. Na 2 weken behandeling wordt aanbevolen een enkele dagelijkse dosis te verdubbelen tot 2,5 mg (met ramipril in de juiste dosering) en vervolgens tot 5 mg na 2 weken behandeling.
Hartfalen met klinische manifestaties
Initiële dosering. Voor patiënten bij wie de toestand is gestabiliseerd na behandeling met diuretica, is Altace kopen de aanbevolen aanvangsdosis 1,25 mg (gebruik ramipril in de juiste dosering) per dag.
Dosistitratie en onderhoudsdosis. De dosis Laceran wordt getitreerd door deze elke 1-2 weken te verdubbelen totdat een maximale dagelijkse dosis van 10 mg is bereikt. Wenselijk o verdeel de dosis over 2 doses.
Secundaire preventie na acuut myocardinfarct bij aanwezigheid van hartfalen
Initiële dosering. 48 uur na het begin van een myocardinfarct krijgen patiënten bij wie de toestand klinisch en hemodynamisch stabiel is, een startdosis van 2,5 mg voorgeschreven (gebruik ramipril in de juiste dosering) 2 keer per dag gedurende 3 dagen. Als de aanvangsdosis van 2,5 mg (gebruik ramipril in de juiste dosering) niet goed wordt verdragen, dient een dosis van 1,25 mg te worden gebruikt (gebruik ramipril in de juiste dosering). 2 keer per dag gedurende 2 dagen, gevolgd door een verhoging tot 2,5 mg (gebruik ramipril in de juiste dosering) en 5 mg 2 keer per dag. Als de dosis niet kan worden verhoogd tot 2,5 mg (gebruik ramipril in de juiste dosering) 2 maal daags, dient de behandeling te worden gestaakt.
Dosistitratie en onderhoudsdosis. In de toekomst wordt de dagelijkse dosis verhoogd door deze te verdubbelen met een interval van 1-3 dagen totdat de beoogde onderhoudsdosis van 5 mg 2 maal daags is bereikt.
Indien mogelijk wordt de dagelijkse onderhoudsdosis verdeeld over 2 doses.
Als de dosis niet kan worden verhoogd tot 2,5 mg (gebruik ramipril in de juiste dosering) 2 maal daags, dient de behandeling te worden gestaakt. Er is nog onvoldoende ervaring met de behandeling van patiënten met ernstig (New York Heart Association (NYHA) functionele klasse IV) hartfalen direct na een myocardinfarct. Als er een beslissing wordt genomen om deze te behandelen patiënten met dit medicijn, wordt aanbevolen om de therapie te starten met een dosis van 1,25 mg (gebruik ramipril in de juiste dosering) 1 keer per dag en elke verhoging ervan moet met uiterste voorzichtigheid worden uitgevoerd.
Speciale categorieën patiënten
Patiënten met een verminderde nierfunctie. De dagelijkse dosis voor patiënten met een verminderde nierfunctie hangt af van de creatinineklaring (zie rubriek "Farmacologische eigenschappen"):
- als de creatinineklaring ≥ 60 ml/min is, hoeft de aanvangsdosis niet te worden aangepast (2,5 mg/dag (gebruik ramipril in de juiste dosering)) en is de maximale dagelijkse dosis 10 mg;
- als de creatinineklaring 30-60 ml / min is, hoeft de aanvangsdosis niet te worden aangepast (2,5 mg / dag (gebruik ramipril in de juiste dosering)) en is de maximale dagelijkse dosis 5 mg;
- als de creatinineklaring 10-30 ml / min is, is de initiële dagelijkse dosis 1,25 mg / dag (gebruik ramipril in de juiste dosering) en de maximale dagelijkse dosis is 5 mg;
- patiënten met arteriële hypertensie die hemodialyse ondergaan: bij hemodialyse wordt ramipril enigszins uitgescheiden; de aanvangsdosis is 1,25 mg (gebruik ramipril in de juiste dosering) en de maximale dagelijkse dosis is 5 mg; Het medicijn moet een paar uur na de hemodialysesessie worden ingenomen.
Patiënten met een verminderde leverfunctie (zie rubriek "Farmacologische eigenschappen"). L de behandeling met Laceran bij patiënten met een verminderde leverfunctie moet onder nauwlettend toezicht worden gestart en de maximale dagelijkse dosis in dergelijke gevallen dient 2,5 mg te zijn (gebruik ramipril in de juiste dosering).
Oudere patiënten. De aanvangsdosis moet lager zijn en de daaropvolgende dosistitratie moet geleidelijker worden uitgevoerd, rekening houdend met de grotere kans op bijwerkingen, vooral bij zeer oude en zwakke patiënten. In dergelijke gevallen dient een lagere aanvangsdosis van 1,25 mg ramipril te worden voorgeschreven (gebruik ramipril in de juiste dosering).
Zie ook de doseringsinformatie hierboven voor patiënten die diuretica krijgen.
Kinderen
Het medicijn Laceran wordt niet aanbevolen voor gebruik bij kinderen (jonger dan 18 jaar), aangezien er onvoldoende gegevens zijn over de werkzaamheid en veiligheid van dit medicijn voor dergelijke patiënten.
Overdosis
Symptomen geassocieerd met een overdosis ACE-remmers kunnen overmatige perifere vasodilatatie zijn (met ernstige arteriële hypotensie, shock), bradycardie, verstoorde elektrolytenbalans en nierfalen. De toestand van de patiënt moet zorgvuldig worden gecontroleerd en er moet symptomatische en ondersteunende therapie worden gegeven. De voorgestelde therapeutische maatregelen omvatten primaire ontgifting (maagspoeling, de introductie van adsorbentia), evenals maatregelen gericht op het herstel van een stabiele bloeding. dynamiek, inclusief de toediening van α1-adrenerge receptoragonisten of angiotensine II (angiotensinamide). Ramiprilaat, de actieve metaboliet van ramipril, wordt slecht uitgescheiden uit de systemische circulatie door hemodialyse.
Bijwerkingen
Het veiligheidsprofiel van het geneesmiddel Laceran bevat gegevens over aanhoudende hoest en reacties veroorzaakt door arteriële hypotensie. Ernstige bijwerkingen zijn onder meer angio-oedeem, hyperkaliëmie, lever- of nierdisfunctie, pancreatitis, ernstige huidreacties en neutropenie/agranulocytose.
De frequentie van bijwerkingen is als volgt geclassificeerd: zeer vaak (≥ 1/10); vaak (van ≥ 1/100 tot < 1/10); zelden (van ≥ 1/1000 tot < 1/100); zelden (van ≥ 1/10.000 tot < 1/1.000); zeer zelden (< 1/10.000), niet bekend (kan met de beschikbare gegevens niet worden berekend). In elke groep worden bijwerkingen weergegeven in afnemende volgorde van ernst.
Tafel 2.
| Klasse orgaansysteem | Bijwerkingen per frequentie | ||||
| Vaak | Zelden | Zelden | Heel zelden | onbekend | |
| Hartaandoeningen | |||||
| Aandoeningen van het bloed- en lymfestelsel | Eosinofilie | Verlaagd aantal witte bloedcellen (waaronder neutropenie of agranulocytose), verlaagd aantal rode bloedcellen, verlaagd hemoglobine, verlaagd aantal bloedplaatjes | Beenmergfalen, pancytopenie, hemolytische anemie | ||
| Aandoeningen van het zenuwstelsel | Hoofdpijn, duizeligheid | Vertigo, paresthesie, ageusie, dysgeusie | Tremor, onbalans | Cerebrale ischemie, waaronder ischemische beroerte en voorbijgaande ischemische aanval; schending van psychomotorische functies; branderig gevoel; parosmie | |
| Aandoeningen van de gezichtsorganen | Visuele stoornissen, waaronder wazig zien | Conjunctivitis | |||
| Aandoeningen van de gehoororganen en het labyrint | Slechthorendheid, lawaai/oorsuizen | ||||
| Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen | Onproductieve prikkelbare hoest, bronchitis, sinusitis, kortademigheid | Bronchospasme, inclusief verergering van astma; verstopte neus | |||
| Maagdarmstelselaandoeningen | Ontstekingsverschijnselen in het maagdarmkanaal, spijsverteringsstoornissen, abdominaal ongemak, dyspepsie, diarree, misselijkheid, braken | Pancreatitis (in zeldzame gevallen zijn sterfgevallen uitsluitend gemeld bij gebruik van ACE-remmers), verhoogde niveaus van pancreasenzymen, angio-oedeem van de dunne darm, pijn in de bovenbuik, inclusief die geassocieerd met gastritis, constipatie, droge mond | Glossitis | Afteuze stomatitis | |
| Russ drielingen uit de nieren en urinewegen | Verminderde nierfunctie, inclusief acuut nierfalen; meer plassen, verslechtering van het verloop van achtergrondproteïnurie, verhoogde ureumspiegels in het bloed; toename van creatinine in het bloed | ||||
| Huid- en onderhuidaandoeningen | Uitslag, vooral maculopapulair | Angio-oedeem, in zeer uitzonderlijke gevallen luchtwegobstructie als gevolg van angio-oedeem, wat fataal kan zijn; jeuk, hyperhidrose | Exfoliatieve dermatitis, urticaria, onycholyse | lichtgevoeligheidsreactie | Toxische epidermale necrolyse, syndroom van Stevens-Johnson, erythema multiforme, pemphigus, exacerbatie van psoriasis, psoriatische dermatitis, pemfigoïd of lichenoïd exantheem of enantheem, alopecia |
| Musculoskeletale en bindweefselaandoeningen | Spierspasmen, myalgie | Artralgie | |||
| Endocriene aandoeningen | Syndroom van ongepaste secretie van antidiuretisch hormoon (SIAH) | ||||
| Stofwisselings- en voedingsstoornissen | Verhoging van het kaliumgehalte in het bloed | Anorexia, verlies van eetlust | Verlaagd natriumgehalte in het bloed | ||
| Bloedvataandoeningen | Arteriële hypotensie, orthostatische verlaging van de bloeddruk, syncope | De getijden voelen | Vasculaire stenose, hypoperfusie, vasculitis | Raynaud-fenomeen | |
| Stoornissen in de algemene toestand | Pijn op de borst, vermoeidheid | koorts | asthenie | ||
| Immuunsysteemaandoeningen | Anafylactische en anafylactoïde reacties, verhoogde niveaus van antinucleaire antilichamen | ||||
| Lever- en galaandoeningen | Verhoogde leverenzymen en/of geconjugeerd bilirubine | Cholestatische geelzucht, levercelbeschadiging | Acuut leverfalen, cholestatische of cytolytische hepatitis (zeer uitzonderlijk fataal) | ||
| Aandoeningen van het voortplantingssysteem en borstklieren | Voorbijgaande erectie-impotentie, verminderd libido | Gynaecomastie | |||
| Psychische aandoening | Verminderde stemming, angst, nervositeit, rusteloosheid, slaapstoornissen waaronder slaperigheid | Het kamp van verward bewustzijn | Aandachtsstoornis | ||
pediatrische populatie. De veiligheid van ramipril werd onderzocht bij 325 kinderen en adolescenten leeftijd 2-16 jaar in 2 klinische studies. Volgens de resultaten waren de aard en ernst van de bijwerkingen bij kinderen vergelijkbaar met die waargenomen bij volwassenen, maar de frequentie van optreden van sommige reacties bij kinderen was hoger dan bij volwassenen, namelijk:
tachycardie, verstopte neus en rhinitis: vaak (d.w.z. ≥ 1/100 tot < 1/10) bij pediatrische patiënten en zelden (d.w.z. ≥ 1/1000 tot < 1/100) bij volwassen patiënten;
conjunctivitis: vaak (dwz ≥ 1/100 tot < 1/10) bij pediatrische patiënten en zelden (dwz ≥ 1/10.000 tot < 1/1.000) bij volwassenen;
tremor en urticaria: zelden (d.w.z. ≥ 1/1000 tot < 1/100) bij pediatrische patiënten en zelden (d.w.z. ≥ 1/10.000 tot < 1/1000) bij volwassen patiënten.
Het algemene veiligheidsprofiel van ramipril bij kinderen en volwassenen is niet significant verschillend.
Meldingen van vermoedelijke bijwerkingen.
Het melden van vermoedelijke bijwerkingen na registratie is een belangrijke maatregel. Ze maken een voortdurende monitoring van de baten/risicoverhouding van het geneesmiddel mogelijk.
Medische professionals moeten gevallen van bijwerkingen melden met behulp van het geneesmiddelenbewakingssysteem van Oekraïne.
Tenminste houdbaar tot
2 jaar.
Opslag condities
Bewaren in de originele verpakking, bij een temperatuur van maximaal 25°C, buiten het bereik van kinderen.
Verpakking< /sterk>
7 tabletten in een blisterverpakking; 2 of 4 blisters in een kartonnen doos.
Categorie vakantie
Op recept.
Fabrikant
Sun Pharmaceutical Industries Limited.
Sun Pharmaceutical Industries Limited.
Locatie van de fabrikant en adres van de vestigingsplaats
Met. Gangwala, Paonta Sahib, Sirmour-district, Himachal Pradesh 173025, India.
V. Ganguwala, Paonta Sahib, District Sirmour, Himachal Pradesh 173025, India.